3. ENLLAÇ QUÍMIC
3.1.- INTRODUCCIÓ.
Dos o més àtoms es poden unir per tal de formar una molècula.
S'anomena enllaç químic la unió entre els àtoms que constitueixen un element o compost.
Aquesta unió es produeix gràcies a les forces d'atracció que s'estableixen entre els àtoms. Són forces de caire elèctric, però amb algunes variacions, depenent de com siguin els àtoms que s'enllacen.
Hi ha tres tipus d’enllaços: L’enllaç iònic, el covalent i el metàl·lic, que donen lloc a diferents tipus de substàncies:
Així doncs, podem dir que el resultat de la unió d'àtoms gràcies a l'enllaç químic pot ser:
Respecte a aquesta Regla de l'octet cal dir que va ser a principis del passat segle XX que els estudis del físicoquímic nordamericà Gilbert Newton Lewis sobre la forma d'enllaçar-se els àtoms van concloure en aquesta coneguda "Regla de l'octet" que podem enunciar de la següent forma:
"Quan es forma un enllaç químic els àtoms reben, cedeixen o comparteixen electrons de tal manera que la capa més externa de cada àtom contingui vuit electrons i així adquireix l'estructura electrònica del gas noble més proper en el sistema periòdic".
Convé puntualitzar que aquells àtoms propers en estructura electrònica a l'heli (He), tenen com a tendència aquests estructura electrònica (1s2), és a dir, tenir dos electrons en la seva capa més externa: H, Li, Be.
També cal dir que trobem algunes excepcions a aquesta Regla de l'octet.
Per representar els enllaços utilitzem l'anomenada Estructura de Lewis, també anomenada diagrama de punt, model de Lewis o representació de Lewis. És una representació gràfica que mostra els enllaços entre els àtoms d'una molècula i els parells d'electrons solitaris que puguin existir.
Aquesta representació es fa servir per saber la quantitat d'electrons de valència d'un element que interactuen amb altres o entre la seva mateixa espècie, formant enllaços ja sigui simples, dobles, o triples i aquests es troben íntimament en relació amb els enllaços químics entre les molècules
A continuació es mostra un video que explica molt bé com fer aquest tipus de representació:
L'enllaç iònic té lloc quan es combinen un metall i un no-metall. El metall aconsegueix la configuració de gas noble cedint electrons i es converteix en un catió. El no-metall capta electrons i es converteix en un anió.
L ’enllaç iònic consisteix en la cessió d’electrons per tal de complir la Regla de l’octet. Com s'ha dit, aquest sempre estarà format per un metall i un no-metall.
Les propietats de les substàncies iòniques són les següents:
- Tenen punts de fusió i ebullició elevats
- Són durs i fràgils
- No condueixen el corrent elèctric en estat sòlid, però si quan es fonen o es dissolen.
- Són solubles en aigua.
- Son sòlids a temperatura ordinària.
- Si els ions de la mateixa càrrega queden a prop, es repel·leixen. Aquesta és la causa que els sòlids iònics es trenquin fàcilment.
En un compost iònic, la fòrmula només ens indica la proporció en què es troben els àtoms. En l'enllaç iònic no es formen molècules aïllades. Els compostos iònics són sòlids cristal.lins.
Ho pots veure també en la molècula del clorur sòdic (NaCl):
I ara t'oferim un video amb més concrecions de l'enllaç iònic i de les xarxes cristal.lines:
També pots veure el video fent click, aquí.
A més t'oferim dos videos més per tal que puguis aprofundir en el coneixement d'aquest tipus d'enllaç:
a) Introducción al enlace químico. ¿Por qué se enlazan los átomos? (Fuente: www.quimitube.com)
b) Propiedades de los compuestos iónicos (Fuente: www.quimitube.com)
3.3.- L'ENLLAÇ COVALENT.
Els enllaços covalents són les forces que mantenen units entre sí els àtoms no-metalls, els àtoms no metàl·lics no poden cedir electrons entre sí per formar ions de signe oposat ja que aquests àtoms tenen tendència a guanyar electrons més que a cedir-los. En aquest cas l'enllaç es forma en compartir un parell d'electrons entre els dos àtoms,però també poden ser dos parells d’àtoms. Aquests electrons són atrets pels nuclis dels àtoms.
Depenent dels parells d’àtoms que comparteixen, hi ha diferents tipus d’enllaç covalent:
1.- Enllaç covalent simple: 1 parell d’electrons compartits. Alguns exemples:
 |
| Molècula d'aigua |
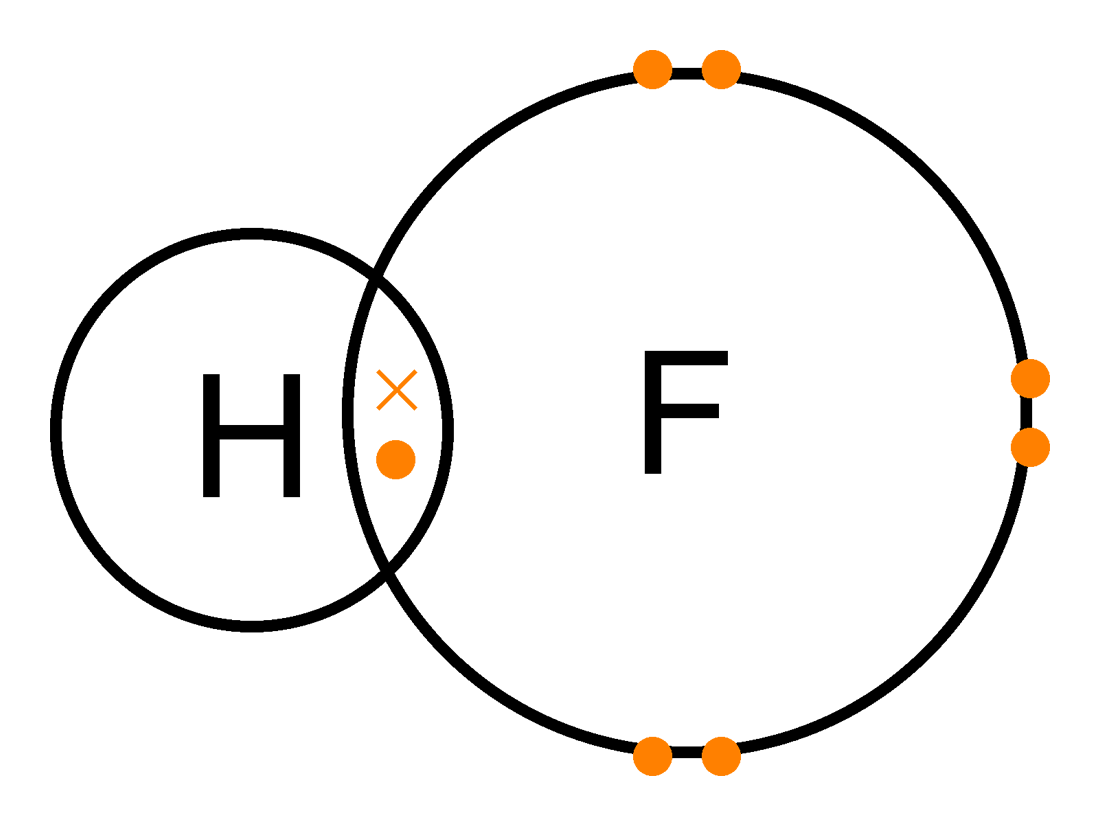 |
| Molècula d'àcid fluorhídric |
 |
| Molècula de clor |
 |
| Molècula de metà |
2.- Enllaç covalent múltiple: Més d'1 parell d’electrons compartits. Es presenten tres tipus diferents:
2.1.- Enllaç doble: Compartició de dos parells d'electrons.
 |
| Molècula de diòxid de carboni |
 |
| Molècula de nitrogen |
L'enllaç covalent també pot aparèixer en molècules molt més grans:
També podem trobar els anomenats cristalls covalents. Un exemple de cristall covalent és el diamant on cada àtom de carboni està unit a altres quatre àtoms de carboni. Tots aquests enllaços carboni-carboni són covalents.
El carboni enllaçat covalentment amb altres carbonis és capaç de formar diferents estructures, el que s'anomenen formes al·lotròpiques.
El diamant és una forma al·lotròpica del carboni, però també ho són el grafit (molt més comú) i el grafè.
Aquest grafè és un material que ofereix moltes possibilitats per les seves propietats. Si voleu conèixer una mica més d'aquest material podeu fer click, aquí.
El video següent t'ajudarà a entendre millor aquest tipus d'enllaç:
Aquí tens una pàgina web amb informació i exercicis. Fes click aquí.
3.4.- L'ENLLAÇ METÀL·LIC
L´enllaç metàl.lic és causat per l´atracció entre els electrons de valència de tots els àtoms i els ions positius que es formen.
Els àtoms metàl·lics perden els electrons de valència i els cations formen una estructura ordenada en la qual els electrons es mouen amb llibertat, formant un núvol electrònic.
El model utilitzat per representar l'enllaç metàl·lic es un núvol d'electrons o mar electrònica. Tal com es veu a les imatges següents, consisteix en posar els cations en forma de xarxa i els electrons de valència a l'espai interatòmic.
Les forces d'atracció entre els ions positius i els electrons són molt fortes.
L'enllaç metàl·lic és característic dels elements metàl·lics, és un enllaç fort, primari, que es forma entre elements de la mateixa espècie. Els àtoms, en estar tan propers uns d'un altre, interaccionen els nuclis juntament amb els seus núvols electrònics empaquetant-se en les tres dimensions, pel que queden envoltats de tals núvols.
 |
Núvol electrònic |
Els àtoms del metall tenen almenys un electró de valència, no comparteixen aquests electrons amb els àtoms veïns, ni perden electrons per a formar els ions.
.png) |
| Enllaç metàl·lic (visió general) |
.png) |
| Enllaç metàl·lic al coure (Cu) |
Per últim, t'oferim un video amb informació d'aquest enllaç metàl·lic. Introducción al enlace metàlico: modelo del mar de electrones o del gas eletrónico. (Fuente: www.quimitube.com)








Cap comentari:
Publica un comentari a l'entrada